CRISPR/Cas9 ve Tarihçesi
CRISPR, Kümelenmiş Düzenli Aralıklı Kısa Palindromik Tekrarlar anlamına gelmektedir. DNA’yı kesebilen bakteriyel bağışıklık sistemlerinin bir bileşenidir ve bir gen düzenleme aracı olarak tasarlanmıştır. CRISPR’lar ilk olarak 1987’de bir Japon bilim adamı Yoshizumi Ishino ve ekibi tarafından E. coli’ de tanımlanmıştır. Ancak, yeterli DNA dizi verisinin olmaması nedeniyle, bu dizilerin işlevi bir sır olarak kalmıştır. CRISPR sistemleri ilk keşfedildiğinde, termofilik arke ve bakterilerde yeni bir DNA onarım mekanizması olduğu düşünülüyordu. 2000’lerin başında, Mojica ve arkadaşları, aralıklı dizilerin bakteriyofajlar, virüsler ve plazmitlerde bulunan dizilere benzer olduğunu fark ettiler. Virüslerin bu aralıklı dizileri enfekte edemediğini keşfettiler ve bu dizilerin prokaryotlarda adaptif bağışıklık sisteminde bir rol oynadığını öne sürdüler. 2020 yılında Nobel Kimya Ödülü, genom düzenleme methodu olan CRISPR/Cas9’u geliştirdikleri için iki bilim insanı Emmanuelle Charpentier ve Jennifer A. Doudna’ya verildi. CRISPR-Cas9 diğer genom düzenleme yöntemlerine kıyasla daha hızlı, ucuz ve kullanım alanı geniş bir yöntem olmasıyla fark yarattı.
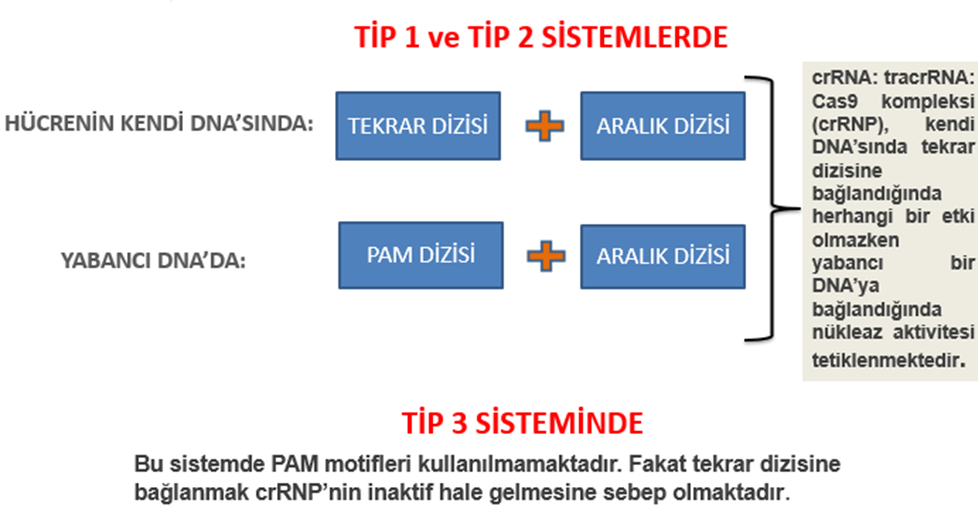
CRISPR Sistemi CRISPR sistemi, bakteri ve arkelerde adaptif bağışıklığın temelidir. Genel olarak, Sınıf 1 (tip I, III, IV) ve Sınıf 2’ye (tip II, V, VI) ayrılabilen altı farklı CRISPR/Cas sistemi türü, çok çeşitli bakteri ve arkelerde tanımlanmıştır. Sınıf 1, birlikte çalışan farklı Cas proteinlerini içerirken, Sınıf 2 sistemleri tek bir Cas proteinini içerir; bu nedenle genom düzenlemede daha basittirler ve tercih edilirler. Sınıf 2 arasından, tip II CRISPR/Cas9 en iyi bilinen sistemlerden biridir. Genel hatları ile sistem işleyişinin kısa özetine bakacak olursak bir bakteri bir virüs tarafından enfekte olduğunda, virüsün DNA’sı hücre tarafından parçalanır ve protospacer olarak bilinen fragman, daha önce hücreyi enfekte etmiş olan diğer virüslerden gelen fragmanlarla birlikte bakteri genomunda depolanır. Bu fragman çeşitli proteinler tarafından işlendikten sonra CRISPR lokusunda yer alır. CRISPR lokusunda ise cas genleri, onu takip eden lider dizi ve sonrasında gelen tekrar (repeat) ve aralık (spacer) dizileri bulunmaktadır. Bir canlı için tekrar dizileri tamamen aynı iken, tekrarların arasındaki aralık dizileri birbirinden farklılık göstermektedir. Protospacer dediğimiz ön aralık geni yeni bir tekrar geni ile birlikte eklenerek aralık geni adını alır.
CRISPR-Cas9 sistemi nasıl çalışır?
(1) CRISPR dizisi, öncül CRISPR RNA (pre-crRNA)’yı oluşturmak için kopyalanır.
(2) Pre-crRNA, trans-aktive edici crRNA (tracrRNA) tarafından crRNA’lara işlenir.
(3) tracrRNA ve Cas9 nükleaz, crRNA ile bir kompleks oluşturur.
(4) crRNA: tracrRNA: Cas9 kompleksi (crRNP), crRNA’yı tamamlayan DNA dizisini arar. crRNA bağlanacağı yerden hemen sonra özel bir Protospacer Bitişik Motifi (PAM) varsa bağlanabilir. PAM’ler, Cas nükleazları tarafından hedeflenen dizilere bitişik bulunan 2-6 baz çiftlik kısa dizilerdir. Cas nükleazları, PAM’leri tanır ve bir PAM olmadığı sürece DNA’yı parçalayamaz. Cas9, PAM’i tanıdığında çift zincir kırıkları oluşturur.
(5) Hücrenin aynı virüs ile tekrar enfekte edilmesi durumunda ise virüsün DNA’sına karşılık gelen aralık dizisini taşıyan bu kompleksler virüs DNA’sını tanır ve Cas proteinlerinin nükleaz aktivitesi ile yabancı DNA parçalanır.
CRISPR-Cas9 sisteminde amaç, DNA’da çift zincirli kırıklar oluşturmak ve bu kırıkları DNA tamir mekanizmaları olan homolog olmayan uç birleştirme (NHEJ) ve homolog rekombinasyon (HR) yoluyla tamir etmektir. HR mekanizmasında, genomun herhangi bir yerinde homolog kromozom ya da kardeş kromatit gibi homolog dizilerin yer alması gerekir. Yani DNA kırığı, sağlam homologu ile tamir edilir. NHEJ’de ise homoloji bilgisine gerek duyulmadan çift zincir kırıkları direkt olarak birleştirilir. NHEJ genleri işlevsiz kılmak için kullanılırken, HDR yeni genler veya genetik materyal parçaları eklemek için kullanılır.
Cas9 çift zincir kırıkları oluşturursa, büyük olasılıkla NHEJ tarafından onarılacaktır. Bununla birlikte, NHEJ hataya açıktır ve genellikle onarılan bölgede eklemeler ve silmeler ile sonuçlanır. Bir genin kodlama bölgesinde silmeler meydana geldiğinde ve çerçeve kayması mutasyonuyla sonuçlandığında, gen işlevsiz hale gelir ve gen nakavt olarak bilinir. Gen nakavtları fonksiyonel genomik, ilaç keşfi, hastalık modellemesi dahil olmak üzere bir dizi araştırma alanında kullanılmaktadır.
CRISPR knock-in
Cas9 tarafından indüklenen çift zincir kırığı durumunda hücreler HDR yoluyla kendilerini onarabilir. Bu yol araştırmacılara yeni bir DNA parçası veya tüm bir gen ekleme fırsatı sunmaktadır. Bu yöntem knock-in olarak bilinir. Bir gen nakavtını elde etmek için, donör kalıbı olarak bilinen bir DNA kalıbı olmalıdır. Bu donör kalıp, kesimin her iki tarafındaki alanla eşleşen homoloji bölgeleriyle çevrili ilgi konusu dizi veya genden oluşur. Knock-in rekombinant proteinlerin üretimi, hücre hatlarının canlılığının arttırılması ve hastalık modellemesi dahil olmak üzere biyoteknolojide önemli bir atılım olmuştur. CRISPR knock-in, genetik mutasyonları düzeltmek için hücre ve gen terapilerinde kullanılabilir. Gen nakavt ile karşılaştırıldığında, gen nakavtları daha zordur. Bunun nedeni, HDR’nin NHEJ’den daha az yaygın bir tamir yolu olması ve yalnızca hücre döngüsünün belirli aşamalarında ortaya çıkmasıdır.
CRISPRa ve CRISPRi
CRISPR-Cas9 genleri silmek veya eklemek için kullanılabilir, ancak küçük değişikliklerle genlerin ekspresyonunu düzenlemek için de kullanılabilir. Bu, CRISPR aktivasyonu (CRISPRa) ve CRISPR interferans (CRISPRi) olarak bilinir. CRISPRa, bir genin ifadesini artırmak için kullanılırken, CRISPRi bir genin ifadesini azaltmak için kullanılır. Bu teknolojilerin her ikisi de, hedef gen ekspresyonunu modüle etmek için katalitik olarak ölü Cas9 (dCas9) olarak bilinen Cas9’un tasarlanmış bir varyantını transkripsiyonel efektörlerle birleştirerek işlev görür. dCas9 DNA’yı kesemez ve bu nedenle transkripsiyonel efektörleri ilgilenilen gene yönlendirir. Bu gen modülatörleri, gelişim biyolojisi, bulaşıcı hastalıklar, fonksiyonel genomik ve ilaç direncine aracılık eden genetik elementlerin taranması dahil olmak üzere birçok araştırma uygulamasında kullanılmaktadır.
CRISPR Teknolojisinin Önemli Uygulamaları
Son birkaç yıl içinde, CRISPR bilimsel araştırmalar üzerinde büyük bir etkiye sahip oldu. Bu teknolojinin bazı temel uygulamalarına bakalım.
1.Hücre ve gen tedavileri
Dr. Doudna ve Dr. Charpentier tarafından uyarlanmasından bu yana, CRISPR/Cas9 teknolojisi hızla ilerledi ve ilerlemeye de devam etmektedir. İnsanlar da dahil olmak üzere çeşitli organizmalarda DNA’yı düzenlemek için kullanıldı. 2019’da, orak hücre anemisi olan hastalardan hücreler toplayan ve bunları vücuda geri vermeden önce in vitro düzenleyerek, hücre tedavisi olarak bilinen bir yöntem olan ilk CRISPR klinik denemeleri başladı. Orak hücre anemisi tedavisi denemelerinin başarısından sonra, 2020’de ilk kez hastalara doğrudan CRISPR tedavisi enjekte edildi.CRISPR, nörodejeneratif hastalıklar ve kanser dahil olmak üzere bir dizi genetik hastalığı tedavi etme potansiyeli ile tıpta devrim yaratmaya devam ediyor. 2019’da CRISPR hücre tedavisinin ilk denemesi, orak hücre hastalığının tedavi edilmesiyle gerçekleştirildi. 2021’de, nörodejeneratif bir hastalık olan transtiretin amiloidoz için önemli CRISPR denemesi çok umut verici sonuçlar verdi. CRISPR, kanseri tedavi etmek için kullanılan bir immünoterapi şekli olan kimerik antijen reseptörü (CAR) T hücrelerini oluşturmak için de kullanılabilir. T hücreleri hastalardan izole edilir ve vücuda yeniden enjekte edilmeden önce kimerik antijen reseptörlerini ifade edecek şekilde tasarlanır. Reseptörler, T hücrelerinin kanser türünü daha iyi bir şekilde hedeflemesine ve yok etmesine izin vermektedir. Henüz klinik deneylerin ilk yıllarında olsak da, bu teknoloji gelecekte BRCA mutasyonlarına bağlı meme ve yumurtalık kanseri, Huntington, Tay-Sachs, Beta-talasemi dahil binlerce genetik hastalığı tedavi etmek için kullanılabilir.
2. Teşhis
COVID 19 pandemisi sırasında CRISPR, hem potansiyel bir terapötik araç hem de koronavirüs için bir teşhis aracı olarak kullanıldı. SHERLOCK™ CRISPR SARS-CoV-2 test kitine, laboratuvar ortamlarında kullanılmak üzere federal yetkililerden acil kullanım izni verildi. Mammoth Biosciences, DETECTR olarak bilinen CRISPR tabanlı bir Covid – 19 teşhis yöntemi de geliştirildi.
3. Tarım
Gen düzenleme teknolojisi, tarımda büyük bir potansiyele sahiptir ve uzmanlar, CRISPR ile modifiye edilmiş gıdaların 5-10 yıl içinde mevcut olacağını öne sürmektedir. Bunun başlıca nedeni, hastalığa ve kuraklığa dayanıklı ekinler oluşturmak için kullanılabilmesidir. Diğer bozulabilir gıdaların raf ömrünü uzatmak, gıda israfını azaltmak ve nispeten düşük maliyetle sağlıklı gıdalara erişim sağlamak için de kullanılabilir.
4. Biyoenerji
Fosil yakıtların önde gelen alternatiflerinden biri olan biyoenerji, bir süredir gündemde ancak uygun ölçekte biyoyakıt üretmenin önünde bazı zorluklar bulunmaktadır. CRISPR ile bilim adamları son zamanlarda bu alanda bazı önemli ilerlemeler kaydedebildiler. Alglerdeki lipid üretimini kontrol eden çoklu transkripsiyon faktörlerini kullanarak biyodizel üretiminde büyük bir artış sağladılar.
5.Kök hücreler ve organoidler
CRISPR düzenlemesi, kök hücre araştırmaları için ezber bozmuştur. Kök hücreler pluripotenttir, yani herhangi bir hücre tipine farklılaşabilirler. Bu onları tıbbi araştırmalarda inanılmaz derecede değerli kılmaktadır. Uyarılmış pluripotent kök hücrelerin (iPSC’ler) ortaya çıkışı büyük bir atılımdı, çünkü bunlar pluripotent olmak üzere yeniden programlanmış yetişkin hücrelerdir (deri veya kan hücreleri gibi). CRISPR, yalnızca iPSC’lerin yeniden programlanmasını kolaylaştırmakla kalmadı, aynı zamanda orijinal olarak iPSC’leri tasarlamak için kullanılan önceki gen düzenleme teknolojilerinden çok daha verimli sonuçlar verdi. CRISPR tarafından düzenlenen iPSC’ler, orak hücre anemisi için CTX001 denemesi ve İndüklenebilir Pluripotent Kök Hücre Nörodejenerasyon Girişimi (iNDI) gibi büyük ölçekli hastalık modelleme çalışmalarında hücre tedavileri başarıyla geliştirildi. CRISPR-Cas9 tarafından düzenlenen iPSC’ler , organoidler oluşturmak için de kullanılabilir. Organoidler, laboratuvarda büyütülebilen insan organlarının küçük, üç boyutlu modelleridir. Son zamanlarda, insan beyninin nasıl evrimleştiğini incelemek için beyin organoidleri üretmek için düzenlenmiş iPSC’ler kullanılmıştır.
CRISPR’ın zorlukları nelerdir?
CRISPR diğer genom düzenleme tekniklerinden daha doğru olmasına rağmen, yine de DNA’daki yanlış yerleri keserek, diğer genleri devre dışı bırakabilecek istenmeyen hedef dışı etkilere yol açabilmesi en büyük dezavantajıdır.
CRISPR’ın Geleceği CRISPR-Cas9 genom mühendisliği alanında devrim yarattı ve bununla birlikte bu inanılmaz teknolojinin faydalarını ve olanaklarını görmeye devam ediyoruz. Çeşitli klinik öncesi çalışmalar ve onaylanan klinik çalışmalar ile hastalıkları iyileştirme hayali artık çok uzak değil. Ayrıca CRISPR-Cas9 gen düzenleme teknolojisine odaklanan artan sayıda biyoteknoloji şirketi var ve birçok araştırmacı epigenom düzenleme, yeni hücre ve gen tedavileri, bulaşıcı hastalıklar dahil olmak üzere dünyadaki sorunları çözmek için ve nesli tükenmekte olan türlerin korunmasına yönelik sürekli olarak bu teknolojiyi uygulamanın yeni yollarını arıyor [1]Nidhi, Sweta, et al. “Novel CRISPR–Cas systems: An updated review of the current achievements, applications, and future research perspectives.” International journal of molecular … Continue reading[2]Kotagama, O.W. et al. Era of genomic medicine: a narrative review on CRISPR technology as a potential therapeutic tool for human diseases. Biomed Research International, 2019 (2019). … Continue reading[3]Gök, Z. G., and B. Ç. Tunalı. “CRISPR-Cas İmmün Sisteminin Biyolojisi, Mekanizması ve Kullanım Alanları. Kırıkkale Üniversitesi Mühendislik Fakültesi Biyomühendislik Bölümü, … Continue reading[4]Öne Çıkan Görsel: images.contentstack.io.
Kaynaklar ve İleri Okuma
| ↑1 | Nidhi, Sweta, et al. “Novel CRISPR–Cas systems: An updated review of the current achievements, applications, and future research perspectives.” International journal of molecular sciences 22.7 (2021): 3327. |
|---|---|
| ↑2 | Kotagama, O.W. et al. Era of genomic medicine: a narrative review on CRISPR technology as a potential therapeutic tool for human diseases. Biomed Research International, 2019 (2019). https://doi:10.1155/2019/1369682. |
| ↑3 | Gök, Z. G., and B. Ç. Tunalı. “CRISPR-Cas İmmün Sisteminin Biyolojisi, Mekanizması ve Kullanım Alanları. Kırıkkale Üniversitesi Mühendislik Fakültesi Biyomühendislik Bölümü, Uluslararası Mühendislik Araştırma ve Geliştirme Dergisi.” International Journal of Research and Development 8.2 (2016). |
| ↑4 | Öne Çıkan Görsel: images.contentstack.io |